您现在的位置是: 首页 > 教育科技 教育科技
小高考内容_小高考知识点
tamoadmin 2024-05-31 人已围观
简介1.小高考复习资料2.小高考政治应该怎样复习有效果3.小高考补考都能过吧4.关于小高考复习5.高中区域地理的中国地理部分的知识点?6.高中政治必修一第二课(多变的价格)知识点归纳7.小高考什么时候你好:记得加分哦 ,你邮箱多少,我发给你doc文档《化学必修1》化学方程式归纳一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na + O2 Na2O22.钠与水反应:_2Na
1.小高考复习资料
2.小高考政治应该怎样复习有效果
3.小高考补考都能过吧
4.关于小高考复习
5.高中区域地理的中国地理部分的知识点?
6.高中政治必修一第二课(多变的价格)知识点归纳
7.小高考什么时候

你好:记得加分哦 ,你邮箱多少,我发给你doc文档
《化学必修1》化学方程式归纳
一、钠及其化合物
1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na + O2 Na2O2
2.钠与水反应:_2Na + 2H2O = 2NaOH + H2↑_离子方程式:2Na + 2H2O = 2Na++2OH- + H2↑
3.钠与硫酸反应:2Na+H2SO4= Na2SO4+H2↑
4.氧化钠与水反应:Na2O+H2O=2NaOH
5.过氧化钠与二氧化碳反应:2Na2O2+ 2CO2 = 2Na2CO3 +O2↑
6.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑ 离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑
7.NaOH溶液中通入少量CO2:2NaOH+CO2= Na2CO3+H2O 离子方程式:2OH-+CO2= CO32-+H2O
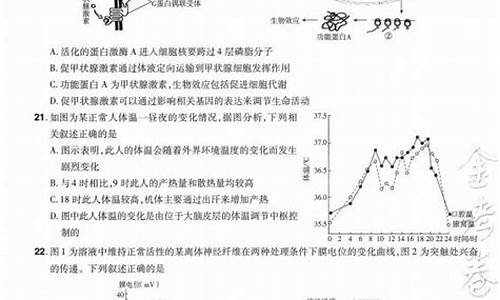
NaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3 离子方程式:_ OH-+CO2= HCO3-_____
8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3 + HCl = NaHCO3+ NaCl
向稀盐酸滴入少量碳酸钠溶液: Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑
②除去碳酸氢钠溶液中混有的碳酸钠: Na2CO3+ H2O +CO2 =2NaHCO3
③碳酸钠与氢氧化钙: Na2CO3 + Ca(OH)2 =CaCO3↓ + 2NaOH
④碳酸氢钠与盐酸: NaHCO3+HCl=NaCl+H2O+CO2↑
⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: NaHCO3+ Ca(OH)2 =CaCO3↓ + NaOH+ H2O
少量氢氧化钙溶液滴入碳酸氢钠溶液中: 2NaHCO3+ Ca(OH)2 =CaCO3↓ + Na2CO3 + 2H2O
⑥除去碳酸钠溶液中的碳酸氢钠: NaHCO3 + NaOH Na2CO3+ H2O
⑦除去碳酸钠固体中的碳酸氢钠: 2NaHCO3 Na2CO3+ H2O +CO2 ↑
⑧鉴别碳酸钠和碳酸氢钠溶液: Na2CO3+ CaCl2 =CaCO3↓ + 2NaCl
二、铝及其化合物
1.铝与氧气的反应:4Al + 3O2 2Al2O3
2.铝与氧化铁反应(铝热反应):2Al + Fe2O3 2Fe + Al2O3
3.铝和稀盐酸:2Al + 6HCl = 2AlCl3+ 3H2↑ 离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑
4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑
5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O
6.氧化铝和NaOH溶液:Al2O3+ 2NaOH 错误!未找到引用源。 2NaAlO2+H2O离子方程式:Al2O3 + 2OH-错误!未找到引用源。2 AlO2-+H2O
7.氢氧化铝和盐酸:Al(OH)3+3HCl =AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O
8.氢氧化铝和NaOH溶液:Al(OH)3+NaOH 错误!未找到引用源。 NaAlO2+2H2O离子方程式:Al(OH)3 +OH- 错误!未找到引用源。 AlO2-+2H2O
9.氢氧化铝受热分解:_2Al(OH)3 Al2O3 +3H2O _
10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______
11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=Al(OH)3↓+3NaCl
AlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH = NaAlO2 + 3NaCl+2H2O
12.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2 =2Al(OH)3↓+Na2CO3
往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2 =Al(OH)3↓+NaHCO3
13.电解氧化铝: 2Al2O34Al+3O2↑
三、铁及其化合物
1.铁与氧气反应:3Fe + 2O2 Fe3O4
铁与硫反应:Fe + S FeS
2.铁与盐酸反应:Fe + 2HCl = FeCl2+ H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑_
铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu_
3.铁和水蒸气:_3Fe + 4H2O(g) Fe3O4 + 4H2_
4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O 离子方程式:FeO+2H+=Fe2++H2O _
5.氧化铁与盐酸反应:_Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O_
6.CO还原氧化铁:_ Fe2O3 +3CO2Fe + 3CO2_
7.氯化铁与氢氧化钠溶液:FeCl3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= Fe(OH)3↓
8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH-= Fe(OH)2↓
9.氢氧化铁加热分解:__2Fe(OH)3Fe2O3+3H2O_____
10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3 _
11.除去FeCl2中的FeCl3:2FeCl3 + Fe =3FeCl2 _离子方程式:2Fe3+ + Fe = 3Fe2+_
12.FeCl2和Cl2反应:_2FeCl2 + Cl2 = 2FeCl3_离子方程式:_2Fe2+ + Cl2= 2Fe3++2Cl-
13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+
14.氯化铁与硫氰化钾溶液反应:_ Fe3+ + 3SCN- =Fe(SCN)3___
四、硅及其化合物
1.硅与氧气加热:Si+O2SiO2
硅与氟气:_ Si+2F2=SiF4 __
2.硅单质与氢氟酸反应:Si+4HF=SiF4+2H2
3.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
4.二氧化硅与氢氟酸反应:_4HF+SiO2=SiF4↑+2H2O _
5.二氧化硅与氧化钙高温反应:SiO2+CaOCaSiO3__
6.二氧化硅与氢氧化钠溶液反应:SiO2 +2NaOH = Na2SiO3 + H2O __
7.二氧化硅与碳反应:_ SiO2 + 2C Si +2CO↑_
8.硅酸钠与盐酸反应:_ Na2SiO3+2HCl=H2SiO3↓+2 NaCl__离子方程式: SiO32-+2H+=H2SiO3↓
9.往硅酸钠溶液中通入二氧化碳:_ Na2SiO3 +CO2+H2O == H2SiO3↓+ Na2CO3_
10.二氧化硅与纯碱反应:SiO2+Na2CO3Na2SiO3+CO2↑_
11.二氧化硅与石灰石反应:_SiO2+CaCO3CaSiO3+CO2↑_
12.加热硅酸:H2SiO3SiO2+H2O
五、氯及其化合物
1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
2.钠在氯气中燃烧:_2Na+Cl2 2NaCl _
铁在氯气中燃烧:2Fe+3Cl2 2FeCl3_
铜在氯气中燃烧:Cu + Cl2 CuCl2
氢气在氯气中燃烧:H2 + Cl2 2HCl _
3.氯气和水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl2 + H2O =H++Cl- +HClO
4.次氯酸光照分解:_2HClO 2HCl + O2↑_
5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-
6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O
7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O _
8.漂白粉漂白原理:_ Ca(ClO)2 + CO2 + H2O=CaCO3↓+ 2HClO _
9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO
10.氯气通入溴化钾溶液:Cl2+ 2KBr = Br2 + 2KCl离子方程式:Cl2+ 2Br- = Br2+ 2Cl-
氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl 离子方程式:_ Cl2 + 2I- = I2 + 2Cl-
溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr 离子方程式:Br2 +2I- = I2+2Br-
11.氯化钠和硝酸银溶液:AgNO3 + NaCl = AgCl↓ + NaNO3 离子方程式:Ag++Cl- = AgCl↓
溴化钠和硝酸银溶液:AgNO3 + NaBr= AgBr↓ + NaNO3离子方程式:Ag++Br- = AgBr↓_
碘化钠和硝酸银溶液:AgNO3 + NaI = AgI↓ + NaNO3 离子方程式:Ag++I- = AgI↓_
六、硫及其化合物
1.硫在空气中燃烧:_ S+O2SO2__
硫与氢气加热: S+H2H2S
2.二氧化硫与水:_ SO2+H2OH2SO3_
二氧化硫与氧化钙:_ SO2+CaO=CaSO3_
少量SO2与氢氧化钠:_2NaOH+SO2=Na2SO3+H2O _离子方程式:_2OH-+SO2= SO32-+H2O_
过量SO2与氢氧化钠:_ NaOH+SO2=NaHSO3_离子方程式:_ OH-+SO2= HSO3-_
3.SO2通入过量的澄清石灰水: Ca(OH)2+SO2=CaSO3↓+H2O
过量的SO2通入澄清石灰水: Ca(OH)2+2SO2=Ca(HSO3)2
4.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O
5.SO2的催化氧化:__2SO2 + O2 2SO3_
6.亚硫酸钠和硫酸反应:_ Na2SO3+H2SO4=Na2SO4+SO2↑+H2O__
7.Na2SO3与氧气反应:_2Na2SO3+O2=2Na2SO4_
8.三氧化硫和水反应:_ SO3+H2O=H2SO4_
9.三氧化硫与氧化钙:__ SO3+CaO= CaSO4_
10.三氧化硫与氢氧化钙:_ Ca(OH)2+SO3=CaSO4↓+H2O _
11.铜与浓硫酸反应:_ Cu + 2H2SO4 (浓) CuSO4 + 2H2O+SO2 ↑_
12.碳与浓硫酸反应:_ C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑_
七、氮及其化合物
1.氮气和氧气反应:_N2 + O2 2NO _
2.工业合成氨:_N2 + 3H2 2NH3_
3.一氧化氮与氧气反应:2NO + O2错误!未找到引用源。 2NO2 _
4.NO2溶于水:_3NO2+ H2O 错误!未找到引用源。 2HNO3+ NO _
5.氨气溶于水: NH3 + H2ONH3·H2O氨水显弱碱性(电离方程式):NH3·H2ONH4+ + OH-
6.浓氨水受热分解_ NH3·H2O NH3↑+H2O __
7.氨气和氯化氢:_ HCl + NH3 = NH4Cl _
8.氨的催化氧化_4NH3+5O2 4NO + 6H2O _
9.氯化铵受热分解:_ NH4ClNH3+HCl _
10.碳酸氢铵受热分解:_ NH4HCO3NH3 ↑+ H2O↑ + CO2 ↑_
11.硝酸铵和NaOH:NH4NO3 +NaOH NaNO3 + NH3↑+H2O_离子方程式:NH4++ OH-NH3↑+H2O
12.实验室制氨气:_2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O
13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O
离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O
14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O
离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O
15.硝酸见光分解:_4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_
16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O
17.NO2、O2混合气通入水中无剩余气体:4NO2+ O2 + 2H2O = 4HNO3
18.NO、O2混合通入水中无剩余气体:4NO +3O2 + 2H2O = 4HNO3
新课标高一必修2化学方程式总汇
(知识点总结)
第一章 物质结构 元素周期律
1、Li与O2反应(点燃)4Li + O2 2Li2 O
Na与O2反应(点燃)2Na+O2Na2O2
Na与H2O反应:2Na+2H2O===2NaOH+H2↑
K与H2O反应:2K+2H2O===2KOH+H2↑
2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应
F2 + H2 === 2HF Cl2 + H2 错误!未找到引用源。= 2HCl Br2 + H2 错误!未找到引用源。= 2Br I2 + H2 错误!未找到引用源。= 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
①Cl2+2NaBr=Br2+2NaCl ②Cl2+2KI=I2+2KCl
(2)溴水与碘化钠溶液反应:Br2+2KI=I2+2KBr
4、Mg与H2O反应:Mg+2H2O 错误!未找到引用源。= Mg(OH)2↓+H2↑ 2Al+6HCl===2AlCl3+3H2↑
Mg+2 HCl 错误!未找到引用源。=MgCl2+ H2↑
5、Na与Cl2、反应(点燃):
6、用电子式表示氯化氢的形成过程:
第二章 化学反应与能量
第三章
1、Ba(OH)2·8H2O与NH4Cl的反应: Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O NaOH+HCl==NaCl+H2O
2、原电池原理
(1)概念:原电池是把化学能转变成电能的装置
(2)典型的原电池(Zn-Cu原电池)
负极(锌):Zn-2e-=Zn2+ (氧化反应)
正极(铜):2H++2e-=H2↑ (还原反应)
电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H+=Zn2++H2↑
3、H2O2在催化剂作用下受热分解:2H2O2=2H2O+O2↑
4、Na2SO4与CaCl2反应 :Na2SO4+CaCl2=CaSO4↓+Na2CO3
5、高炉炼铁:2C + O2 = 2CO Fe2O3 + 3CO 错误!未找到引用源。2Fe + 3CO2
第三章 有机化合物
1、甲烷的主要化学性质
(1)氧化反应(与O2的反应):CH4(g)+2O2(g) CO2(g)+2H2O(l)
(2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物):
①
②
③
④
2、乙烯的主要化学性质
(1)氧化反应:C2H4+3O2 2CO2+2H2O
(2)加成反应
乙烯还可以和氢气、氯化氢、水等发生加成反应。
CH2=CH2+ H2CH3CH3
CH2=CH2+HClCH3CH2Cl(一氯乙烷)
CH2=CH2+H2OCH3CH2OH(乙醇)
(4)聚合反应:
(乙烯制聚乙烯)
(氯乙烯制聚氯乙烯)
3、苯的主要化学性质:
(1)氧化反应(与O2的反应): 2C6H6+15O2 12CO2+6H2O
(2)取代反应
① 与Br2的反应 :① + Br2 + HBr
② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
+ HONO2 + H2O
(1) 加成反应
用镍做催化剂,苯与氢发生加成反应,生成环己烷。
+ 3H2
4、乙醇的重要化学性质
(1)乙醇与金属钠的反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑
(2)乙醇的氧化反应
①乙醇的燃烧CH3CH2OH+3O2 2CO2+3H2O
②乙醇的催化氧化反应2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
③乙醇在常温下的氧化反应
CH3CH2OHCH3COOH
5、乙酸的重要化学性质
(1) 乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2) 乙酸的酯化反应乙酸的酯化反应
①反应原理
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、①蔗糖水解反应:C12H22O11+H2O→C6H12O6+C6H12O6
②淀粉(纤维素)水解反应:
③油脂的重要化学性质——水解反应
a)油脂在酸性条件下的水解:油脂+H2O甘油+高级脂肪酸
(1) 油脂在碱性条件下的水解(又叫皂化反应)
油脂+H2O甘油+高级脂肪酸
蛋白质+H2O各种氨基酸
第四章 化学与可持续发展
1、HgO受热分解:2HgO 2Hg + O2↑
Ag2O受热分解:2Ag2O 4Ag + O2↑
2、CO还原Fe2O3:Fe2O3+ 3CO 2Fe +3CO2 (高炉炼铁)
①C 还原ZnO :2 ZnO + C 2 Zn +CO2↑
②C 还原MgO : MgO +C Mg + CO↑
③Al 还原Fe2O3(铝热反应): Fe2O3 + 2Al 2Fe + Al2O3
④Fe还原CuSO4: CuSO4+ Fe ==== FeSO4 +Cu (湿法炼铜)
3、电解
①电解NaCl:2NaCl(熔融) 2Na +Cl2↑
②电解MgCl2: MgCl2(熔融) Mg +Cl2↑
③电解Al2O3: 2Al2O3(熔融) 4Al + 3O2↑
4、石油的催化裂化,例如:C4H10裂化得到乙烯和乙烷:例如:C4H10 C2H4 + C2H6
C16H34 C8H18+C8H16
C8H18 C4H10+C4H8
C4H10 CH4 + C3H6
C4H10 C2H4+ C2H6
小高考复习资料
小高考特指普通高中学业水平考试,也就是人们所说的会考,考试对象为普通高中高二年级的学生,考试成绩将作为高校招生录取的依据之一。很多大学也对小高考成绩有所要求,因此从2011年起,一些高校的自主招生考试也被称为小高考。
一共考四门。
高考时考语数外和两门选修。
具体科目设置如下:
1.学业水平测试科目共有7门:政治、历史、地理、物理、化学、生物、技术(含信息技术、通用技术)。
2.学业水平测试分必修科目和选修科目,其中必修科目5门,选修科目2门。选修科目由考生在历史、物理两门中选择一门,在政治、地理、化学、生物四门中选择一门。7门学业水平测试科目中,2门选修科目之外的5门为必修科目。此为江苏08方案高考政策,全国绝无仅有。
3.艺术类、体育类考生如不兼报普通类专业,可选择7门均为必修科目。
扩展资料:
计分规则:
1.学业水平测试实行等级计分,分为4个等级,用A、B、C、D表示。技术科目测试等级为合格、不合格。
2.必修学科等级计算方法:各科原始分满分为100分。100分~90分为A级,89分~75分为B级,74分~60分为C级,59分及其以下为D级。单科C级及其以上的比例一般控制在95%以上。
3.选修学科等级计算方法:各科原始分满分为120分,根据考生成绩按比例折换成相应的等级。A级为前20%(含20%)的考生(前5%为A+),B级为前20%至前50%(含50%)的考生,C级为前50%至前90%(含90%)的考生,D级为90%以后的考生。
4.必修学科的成绩从应届高考之年起算,三年有效;选修学科的成绩当年有效。
5.必修科目考试只要有一项科目为D等者(信息技术考试不合格视作D等),将不能填报高考普通类志愿。
6.第一次报名参加必修科目考试单科成绩每得到一个A等级,则可在次年高考总分中加1分,如得4个A,则可以加5分。
由于前几年“小高考”试卷比较平稳,难度不算高,教育部门这两年出卷时进行了相应调整。这也提醒老师和学生,在小四门科目的学习上,不能仅仅局限于知识点的死记硬背,沉浸于刷题、考前猜题押宝,要注重和生活实际相结合,培养学生灵活运用知识、分析问题和解决问题的能力,只有这样才能以不变应万变。
“小高考”增加难度,实际上是为了引导各学校和学生不要以冲“A”为目的。“‘小高考’是过关考试,但是这些年各学校都走偏了,花了大把的力气,投了很多精力,甚至打乱了教学节奏,就为了在高考中加几分。”“小高考应该回归过关考试的性质,淡化加分,才能给学生和学校松绑。”
光靠增加难度,引导学生、学校回归理性并不现实,教育部门应该从制度设计上进行引导和变革,才能真正破解“小高考”一窝蜂冲A的问题。
参考链接:百度百科-小高考小高考政治应该怎样复习有效果
作为目前高三学生家长,我对于江苏小高考有三条建议:
一、从态度上要重视,平时跟着老师的节奏搞好复习,认真对待老师发的训练题,及时做,批改后反思。
二、到图书市场上买两套小高考的辅导书,其中一套是内容分类整理与解析,另一套是往年考试题和模拟题,上面有近年的试卷和答案 还有几十套模拟题。
三、寒假可以报个辅导班,也不需要一对一。江苏各市 应该都有 志善教育的针对小高考的辅导班。去年寒假 我小孩到那上过辅导班 效果不错。请在网上查看相关信息,然后打电话咨询。
小高考补考都能过吧
1、先学会梳理自身学习情况,以课本为基础,结合自己做的笔记、试卷、掌握的薄弱环节、存在的问题等,合理的分配时间,有针对性、具体的去一点一点的去攻克、落实。哪块内容掌握的不好就多花点时间,复习的时候要系统化,不要东一下西一下,最后啥都没复习好。
2、可以学习掌握速读记忆的能力,提高学习复习效率。速读记忆是一种高效的学习、复习方法,其训练原理就在于激活“脑、眼”潜能,培养形成眼脑直映式的阅读、学习方式。速读记忆的练习见《精英特全脑速读记忆训练》,用软件练习,每天一个多小时,一个月的时间,可以把阅读速度提高5、6倍,记忆力、理解力等也会得到相应的提高,最终提高学习、复习效率,取得好成绩。如果你的阅读、学习效率低的话,可以好好的去练习一下。
3、要学会整合知识点。把需要学习的信息、掌握的知识分类,做成思维导图或知识点卡片,会让你的大脑、思维条理清醒,方便记忆、温习、掌握。同时,要学会把新知识和已学知识联系起来,不断糅合、完善你的知识体系。这样能够促进理解,加深记忆。
4、做题的时候要学会反思、归类、整理出对应的解题思路。遇到错的题(粗心做错也好、不会做也罢),最好能把这些错题收集起来,每个科目都建立一个独立的错题集(错题集要归类),当我们进行考前复习的时候,它们是重点复习对象,保证不再同样的问题上再出错、再丢分。
关于小高考复习
小高考补考不是都能过。小高考补考通过的几率是较高的,小高考补考的难度比第一次考试低,而且补考时还会有平时分,只要认真复习,通过的几率是较高的,对于一些科目来说,包括物理和化学,因为题型的原因,很多学生很难在短时间内掌握所有的知识点,这些科目的小高考补考相对来说难度更大,小高考补考不是都能过但能过并且很好过,对自己的小高考成绩不满意,一定要及时进行补考。小高考专指普通高中学业水平考试,被称为会考,该考试的对象为普通高中二年级的学生,成绩将作为高校招生录取的依据之一。
高中区域地理的中国地理部分的知识点?
如何进行小高考复习这一问题,应该根据自己的实际情况来确定:\x0d\1、对于自己的强项,要适当巩固,不要忽略;\x0d\2、对于自己的弱项,要重点突破,把要点难点吃透;\x0d\3、对于不强不弱的科目,重点解决自己掌握得不太牢靠的部分;\x0d\4、对辅导老师的考前讲解和练习要加倍努力,领会其中的要点,突破难点。\x0d\综上所述,只要按上述方法,认真复习,再加上注意学习和休息的时间分配,还有生活上的营养跟进,考出较好的成绩不是难事。
高中政治必修一第二课(多变的价格)知识点归纳
自然地理方面:
(1)气候(这个要注意下,因为很多题目里面会用得到,虽然不是明着考,但与之息息相关,比如农业那边,也不用记得太详细,只要记得大体的就行,这里面包括很多,大致的地形,气候,风向带等等这类的)
(2)地形(大体的地形要记得,其各自的特征也要熟记,因为这个很常考)西北的荒漠化,青藏高原的地形对西北风的影响,云贵高原的喀斯特地形等等,这些的出题频率都很高
(3)农业(这个结合上面的两点来看,对于大致的每个地方的物产要记得些,因为会在综合的大题里面考,比如南方的水稻,北方的小麦(南方是冬小麦,北方是春小麦)其生长条件是什么,这里就要考虑到土壤、地形、气候、水源这类的了)
人文地理:
这块嘛,主要是要记得书上的那些例子,比如山西的煤矿、四川的水电,不仅要记得这些例子,还要搞清楚这些物产为什么会在那里,也就是产生这些物产的条件,比如说水电,南方的水力发电,最主要的两个条件就是要有大量的水资源,在一个就是要有地形上的条件——地势落差大。搞清楚的这些,就能举一反三,试卷上的题目不可能跟书上一样的,但是万变不离其宗,试卷上不管是说的哪里,只要是符合条件了,书上的那些就能往上套。比如,工业污染造成的酸雨,只要是产生的酸性气体,也就是排放废气,不管在哪里都会产生酸雨。
其实中国地理考来考去也就那么点,最主要的还是要在做题中总结经验,我两年前高考的时候,整个高三基本没再翻过地理书,试卷也做的很少,(我高三毕业之后,才敢跟我的地理老师讲这件事。因为我的地理考了A+,我是学历史的,也是这种情况)
一个原因是我的语数外不好,而江苏高考就看语数外,另一个就是有些题目,再怎么改说法,答案还是那个,没什么用处,所以如果是高中地理要参加高考的话,最好在高二开始一轮复习的时候就要注意总结,免得高三的时候分心。如果是参加小高考的话,那么就记住老师给你们复习时候讲的就行了。
以上是我个人经验,希望对你有所帮助。
小高考什么时候
小高考要求:8、供求关系对商品价格的影响B
(1)各种因素对商品价格的影响,是通过改变该商品的供求关系来实现的。
(2)供求影响价格:供过于求引起价格下降,供不应求引起价格上升
9、价格与价值的关系B
(1)价值决定价格,价值是价格的基础;(2)价格是价值的货币表现。
10、价值规律的内容及表现形式B
(1)价值规律的基本内容:①商品的价值量由生产该商品的社会必要劳动时间决定,②商品交换以价值量为基础实行等价交换。
(2)价值规律的表现形式:受供求关系的影响,商品价格围绕价值上下波动。
11、价格变动对人们生活和生产经营的影响B
(1)对人们生活的影响
①一般而言,当某种商品的价格上升时,人们会减少对它的购买;当这种商品的价格下降时,人们会增加对它的购买;
②价格变动对生活必需品需求量的影响较小,对高档耐用品需求量的影响比较大;
③在互为替代品的两种商品中,一种商品价格上升,消费者将减少对该商品的需求量,导致其替代品的需求量增加。反之,一种商品价格下降,消费者将增加对该商品的需求量,导致其替代品的需求量减少。
④在互补商品中,一种商品价格上升,消费者将减少对该商品的需求量,同时也减少其互补商品的需求量。反之,一种商品价格下降,消费者将增加对该商品的需求量,同时也增加其互补商品的需求量。
(2)对生产经营的影响
①调节生产规模;②提高劳动生产率;③生产适销对路的高质量产品。
考试时间为2023年2月18日—20日。
信息技术科目考试(机考)、考试时间为2023年2月18日—20日。分三天进行,每天6场,每场60分钟。具体如下:语文、数学、外语、思想政治、历史、地理、物理、化学、生物科目考试(笔试)、考试时间为2023年2月25日—27日。除语文科目考试时长为90分钟外,其他各科目均为75分钟。按照往年的做法,高考成绩一般在4月10日左右公布,然后可以登录教育考试院官网查询成绩。高考是指普通高中的学术水平考试,也就是人们所说的会考。考试对象为普通高中二年级学生,考试成绩将作为高校招生的依据之一。小高考可以报考的学校有顺德职业技术学院、广东轻工职业技术学院、广东交通职业技术学院、广东水利电力职业技术学院、深圳职业技术学院等等。小高考特指普通高中学业水平考试,也就是人们所说的会考,考试对象为普通高中高二年级的学生,考试成绩将作为高校招生录取的依据之一。很多大学也对小高考成绩有所要求,因此从2011年起,一些高校的自主招生考试也被称为小高考。小高考题目大部分是极其基础的,重要的就是将知识点搞清楚,不要打结专错乱。另外,注意题目的属问法,不要粗心。注意考试时间,特别是文科的题目答题量很大,很需费时间,不要耽搁,时间很快就会过去。